「再生医療等安全性確保法」の第一章第一条には、この法律の目的が示されています。
「この法律は、再生医療等に用いられる再生医療等技術の安全性の確保及び生命倫理への配慮(以下「安全性の確保等」という)に関する措置その他の再生医療等を提供しようとする者が講ずべき措置を明らかにするとともに、特定細胞加工物の製造の許可等 の制度を定めること等により、再生医療等の迅速かつ安全な提供及び普及の促進を図り、もって医療の質及び保健衛生の向上に寄与することを目的とする」
法律ですから、わかりにくいのですが、要するに「安全性の担保された再生医療をできるだけ早く患者様に提供することで、医療の質や保健衛生の質が高まる」と厚生労働省が認めてくれたということです。
この法律のポイントは次の3つです。
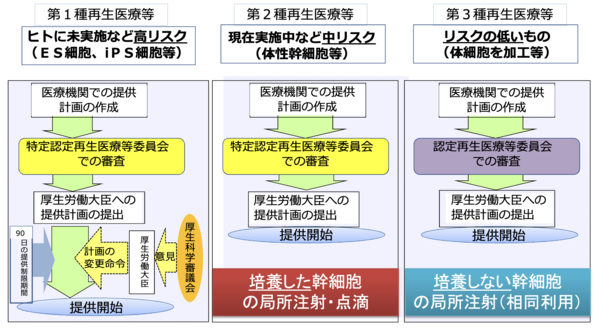
〇第一種再生医療等
ヒトに対してまだ実施されていない、高リスクな技術を要するもので、ES細胞、iPS細胞などを用いた再生医療です。
〇第二種再生医療等
中程度のリスクを伴う治療で、培養した幹細胞を注射や点滴で体内に入れるもの。クリニックレベルでも提供が可能で、当クリニックで行っている治療もおもに第二種再生医療等です。
〇第三種再生医療等
もっともリスクが低く、培養しない幹細胞の局所注射などが該当します。血小板療法を用いた歯科医のインプラント治療も第三種で血小板療法では、患者様の血液から血小板を分離して治療に用います。現在、血小板療法の登録をしている医療機関の2/3が歯科医院です。
厚生労働省への届け出が必要
再生医療施設として治療を行うためには、提供する医療の計画書を作成し、(特定)認定再生医療等委員会に提出して審査を受けなければなりません。審査に合格すると、厚生労働大臣へ提供計画書を提出します。
リスク分類の第二種、第三種の再生医療は、書類が受理されれば医療提供が可能になりますが、リスクの高い第一種はさらに厚生科学審議会の意見を受け、計画の変更等をしたのちに医療提供ができます。
再生医療が受けられる医療機関を探す際は、厚生労働省のホームページでチェックするのが安心です。
無届けで治療や細胞加工を行った場合は、法律によって罰則が科せられます。
細胞培養を外部委託できる
「再生医療等安全性確保法」ができるまでは、細胞を用いる医療機関は、培養も投与も自分たちの病院なりクリニックで全て行い、責任を持つ方式でした。
しかし、新法では細胞培養や細胞加工を外部の施設に委託していいことになったのです。これが再生医療の裾野を大きく広げました。細胞培養の施設を院内に作ろうとすると、設備投資が必要になり、資金やスペース確保などが大きな壁になっていたからです。
当クリニックは、細胞培養施設を院内に設けました。クリニックレベルでは珍しい例ですが、どうしても医療と細胞培養の両方を兼ね備えることにこだわったのです。
細胞培養に必要な設備や、培養方法については、改めて解説いたします。